شرکت پاکدان پارت سپاهان
شرکت خدماتی ، فنی ، بازرگانیشرکت پاکدان پارت سپاهان
شرکت خدماتی ، فنی ، بازرگانیفلز آلومینیوم
تاریخچه کشف آلومینیوم
"فردریک
وهلر" بهطور کلی به آلومینیوم خالص اعتقاد داشت. اما این فلز دو سال
پیشتر بهوسیله "هانس کریستین ارستد" شیمیدان و فیزیکدان دانمارکی بدست
آمد. در روم و یونان
باستان این فلز را به عنوان ثابتکننده رنگ در رنگرزی و نیز بهعنوان
بندآورنده خون زخمها بکار میبردند و هنوز هم بهعنوان داروی بند آورنده
خون مورد استفاده است. در سال ۱۷۶۱، "ویتون دموروو" پیشنهاد کرد تا alum
را آلومین (alumin) بنامند.
پیدایش و منابع
اگر
چه آلومینیوم، یک عنصر فراوان در پوسته زمین است (۱۸٪)، این عنصر در حالت
آزاد خود بسیار نادر است و زمانی یک فلز گرانبها و ارزشمندتر از طلا به
حساب میآمد. بنابر این، به عنوان فلزی صنعتی اخیرا مورد توجه قرار گرفته و
در مقیاسهای تجاری تنها بیش از ۱۰۰ سال است که مورد استفاده است. در
ابتدا که این فلز کشف شد، جدا کردن آن از سنگها بسیار مشکل بود و چون کل
آلومینیوم زمین بهصورت ترکیب بود، مشکلترین فلز از نظر تهیه به شمار
میآمد.
آلومینیوم برای مدتی از طلا با ارزشتر بود، اما بعد از
ابداع یک روش آسان برای استخراج آن در سال ۱۸۸۹، قیمت آن رو به کاهش گذاشت و
سقوط کرد. تهیه مجدد این فلز از قطعات اسقاط (از طریق بازیافت) تبدیل به
بخش مهمی از صنعت آلومینیوم شد. بازیافت آلومینیوم موضوع تازهای نیست،
بلکه از قرن نوزدهم یک روش رایج برای این کار وجود داشت. با این همه تا
اواخر دهه ۶۰ این یک کار کم منفعت بود تا زمانی که بازیافت قوطیهای
آلومینیومی آشامیدنیها بالاخره بازیافت این فلز را مورد توجه قرار داد.
منابع بازیافت آلومینیوم عبارتند از: اتومبیلها، پنجرهها، درها، لوازم
منزل، کانتینرها و سایر محصولات.
معرفی
آلومینیوم،
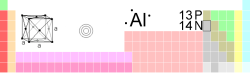
عنصر شیمیایی است که در جدول تناوبی دارای علامت Al و عدد اتمی ۱۳
میباشد. آلومینیوم که عنصری نقرهای و انعطافپذیر است، عمدتا به صورت سنگ
معدن بوکسیت یافت میشود و از نظر مقاومتی که در برابر اکسیداسیون دارد،
همچنین وزن و قدرت آن، قابل توجه است. آلومینیوم در صنعت برای تولید
میلیونها محصول مختلف بهکار میرود و در جهان اقتصاد، عنصر بسیار مهمی
است.
اجزای سازههایی که از آلومینیوم ساخته میشوند، در صنعت
هوانوردی و سایر مراحل حملونقل بسیار مهم هستند. همچنین در سازههایی که
در آنها وزن پایداری و مقاومت لازم هستند، وجود این عنصر اهمیت زیادی
دارد.
ویژگیهای قابل توجه
آلومینیوم،
فلزی نرم و سبک، اما قوی است، با ظاهری نقرهای - خاکستری مات و لایه نازک
اکسایش که در اثر برخورد با هوا در سطح آن تشکیل میشود، از زنگ خوردگی
بیشتر جلوگیری میکند. وزن آلومینیوم تقریبأ یک سوم فولاد یا مس است.ِ چکش
خوار، انعطافپذیر و به راحتی خم میشود. همچنین بسیار بادوام و مقاوم در
برابر زنگزدگی است. بهعلاوه، این عنصر غیر مغناطیسی، بدون جرقه، دومین
فلز چکشخوار و ششمین فلز انعطافپذیر است.
کاربردها
چه از نظر کیفیت و چه از نظر ارزش، آلومینیوم کاربردیترین فلز بعد از
آهن است و تقریبا در تمامی بخشهای صنعت دارای اهمیت است. آلومینیوم خالص،
نرم و ضعیف است، اما میتواند آلیاژهایی را با مقادیر کمی از مس، منیزیوم،
منگنز، سیلیکون و دیگر عناصر بوجود آورد که ویژگیهای مفید گوناگونی دارند.
این آلیاژها اجزای مهم هواپیماها و راکتها را میسازند.
وقتی
آلومینیوم را در خلاء تبخیر کنند، پوششی تشکیل میدهد که هم نور مرئی و هم
گرمای تابشی را منعکس میکند. این پوششها لایه نازک اکسید آلومینیوم محافظ
را بوجود میآورند که همانند پوششهای نقره خاصیت خود را از دست نمیدهند.
یکی دیگر از موارد استفاده از این فلز در لایه آینههای تلسکوپهای نجومی
است.
برخی از کاربردهای فراوان آلومینیوم عبارتند از:
حمل و نقل (اتومبیلها، هواپیماها، کامیونها، کشتیها، ناوگانهای دریایی، راه آهن و...)
بستهبندی (قوطیها، فویل و...)
ساختمان (درب، پنجره، دیوار پوشها و...)
کالاهای با دوام مصرف کننده (وسایل برقی خانگی، وسایل آشپزخانه، ...)
خطوط انتقال الکتریکی (بهعلت وزن سبک اگرچه هدایت الکتریکی آن تنها ۶۰٪ هدایت الکتریکی مس میباشد)
ماشینآلات
اکسید آلومینیوم (آلومینا) به طور طبیعی و بصورت کوراندوم، سنگ سنباده،
یاقوت و یاقوت کبود یافت میشود که در صنعت شیشهسازی کاربرد دارد. یاقوت و
یاقوت کبود مصنوعی در لیزر برای تولید نور همنوسان به کار میروند.
آلومینیوم با انرژی زیادی اکسیده میشود و در نتیجه در سوخت موشکهای با سوخت و دمازاها مورد استفاده واقع میشود. 
در
طی جنگ جهانی اول و دوم، آلومینیوم به مقدار قابل توجهی تولید و به عنوان
ماده سبک و مناسب در ساخت هواپیماهی جنگی به کار گرفته شد.
صنایع آلومینیوم سازی در این زمان پیشرفت چشمگیری یافتند. بعد از جنگ جهانی کشورهایی همچون کانادا و آمریکا
که اکنون صاحب صنایع عظیمی در زمینه آلومینیوم هستند و گستره عظیمی از این
صنعت را در اختیار دارند متوجه اهمیت کاربرد آلومینیوم در سایر صنایع و از
جمله در ساختمانسازی شدند.
آلومینیوم به دلیل خواص ویژه ای که
دارد توانسته است طی 50 سال اخیر پیشرفت چشمگیری را در صنایع ساختمانی پیدا
کند. چنانچه میزان مصرف آن از سال 1960 تا سال 1998 روند صعودی داشته است.
امروزه حدود 35 در صد از آلومینیوم تولیدی دنیا در صنایع ساختمانی
مصرف میشود. آلومینیوم به اشکال مختلف در ساختمان به کار میرود.
آلومینیوم اکسترود شده، نورد شده و ریختگی برای ساخت قالبهای در و پنجره،
سقف، کف کاذب، نما، یراقآلات، پرده دیواری، سیستمهای حرارتی و تهویهای،
پرده و حفاظ، سایبان و پارتیشنها و پانلها، ساختمانهای پیشساخته،
خانههای سبز و داربستها استفاده میشود. مهمترین دلیلی که باعث شده تا
آلومینیوم با این وسعت و به این اندازه در صنایع ساختمانی به کار رود
عبارتند از: سبکی و وزن کم تجهیزات آلومینیومی فاکتور بسیار مهمی در
کاربردهای مهندسی ساختمان محسوب میشود. آلومینیوم فلزی است با وزنی حدود
یک سوم وزن فولاد، ین سبک وزنی و همچنین قابلیت شکلپذیری بالا ، آلومینیوم
را فلزی مناسب جهت ساخت در و پنجره تبدیل نموده است. موارد آلومینیومی
مصرفی در ساختمان طول عمر بالایی داشته و به تعمیر و نگهداری نیازی ندارند.
آلومینیوم موجب میشود خطرات احتمالی ناشی از زلزله به حداقل برسد. همچنین
بار استاتیکی وارد بر ساختمان کم گردد و در نتیجه مصالح مورد نیاز نیز
کاهش یابد و فشار کمتری به پی ساختمان وارد شود و فونداسیون ساختمان را
بتوان با مواد کمتری طراحی کرد.
نسبت استحکام به وزن بالای
آلومینیوم از خواصی است که در صنعت ساختمانسازی اهمیت ویژهای را به آن
میدهد. آلومینیوم دارای چگالی حدود 2/7 گرم بر سانتیمتر مکعب است، یعنی
حدود یک سوم چگالی فولاد،
استحکام آلیاژهای آلومینیوم را نیز میتوان با انتخاب آلیاژ مناسب و گاه
با اعمال عملیات حرارتی خاص به حد استحکام فولاد رساند، در نتیجه میتوان
آلومینیوم با استحکام و سختی بالا به دست آورد و در ساخت حمایلها و
فرمهای پنجرهها و درها استفاده کرد. سختی و استحکام مواد آلومینیومی باعث
میشود که یک نوار باریک برای قاب آلومینیومی بتواند در مقابل بارها و
تنشهای اعمالی پایدار بماند و این مورد در ساختمانهای بلند از اهمیت
ویژهای برخوردار است، زیرا پایداری و ثبات استاتیکی از خواص ضروری برای
پنجرهها، سردرها و سایبانها محسوب میشوند. سردرهای آلومینیومی به عنوان
پوششی در مقابل نور و حرارت به کار میروند و کاربرد آنها در ساختمانهای
غیر مسکونی بیشتر میباشد. این پوششها باعث افزایش عمر ساختمان میشوند،
خواص عایقبندی مناسب را فراهم میکنند و بازده بهرهبرداری از انرژی را
تقویت میکنند.
نسبت استحکام به وزن بالای آلومینیوم، باعث شده که
این فلز به عنوان ماده مناسب برای کاربرد در نماسازی مطرح باشد. علاوه بر
آن موجب کاهش هزینههای حمل و انتقال تجهیزات میشود. وزن کم محصولات
آلومینیومی جابهجایی آن را از مکانی به مکان دیگر تسهیل مینماید.
پانلهای رول شده با وزن مخصوص کم، قابل جابجایی با دست میباشند و نیاز به
تجهیزات عظیم و سنگین ندارند. سازههای سبک و پارتیشنهای آلومینیومی به
راحتی قابل اتصال و جابجایی میباشند و نصب آنها با سرعت و سهولت
امکانپذیر است.
یکی دیگر از خواص آلومینیوم در صنایع ساختمانی
قرار گرفتن آلومینیوم در زمره مواد غیر مشتعل میباشد زیرا که آلومینیوم
نمیسوزد و قابل اشتعال نیست و در آتشسوزی در زمره مواد غیر مشتعل شونده
دستهبندی میشود.
آلومینیوم در 650 درجه سانتیگراد ذوب میشود که
تا رسیدن به این دما به زمان نسبتاً زیادی نیاز است. در یک آتشسوزی بزرگ
این خاصیت یک مزیت مهم به شمار میرود زیرا که انرژی آتش صرف ذوب و گرم
کردن آلومینیوم میشود. سقفهای صنعتی و دیوارهای خارجی ساخته شده از
پانلهای نازک آلومینیوم طوری طراحی میشوند که در یک آتشسوزی بزرگ ذوب
شوند. در نتیجه ساختمان باز شده، گرما و دود آزاد شده و اجازه خروج پیدا
میکند و در نتیجه دمای اعمال شده به ساختار کم می شود و خاموش کردن آتش
آسانتر انجام میگیرد. در نتیجه سازه اصلی ساختمان سالم باقی میماند.
خطرات ریزش نیز کمتر میشود و در ضمن نیاز به بازسازی کامل سازهها بعد از
آتش سوزی نیز از بین میرود. علاوه بر مسائل فوق نکته مهم این است که
آلومینیوم در حین گرم شدن و حتی ذوب شدن هیچ نوع گاز و دود خطرناک و سمی
تولید نمیکند، در نتیجه در مقایسه با در و پنجرههای چوبی و یا PVC به
دلیل عدم تولید گاز یا دود خطرناک از کیفیت بالاتری برخوردار است.
آلومینیوم سخت، محکم و پایدار است و یکی از مزایای پنجره های آلومینیومی بر
پنجرههایی از جنس چوبی و یا وینیلی(PVC) سختی آنها است. آلومینیوم
تقریباً 2/23 برابر سختتر از وینیل و 2/7 برابر سختتر از چوب است.
لذا
در و پنجره و سازههای آلومینیومی در برابر کج شدن و اعوجاج ناشی از تحرک
ساختمان مشکلی از خود نشان نمیدهند و در برابر بارهای اعمالی تغییر شکل
نداده و دفورمه نمیشوند. بر خلاف سایر موارد مصالح ساختمانی، آلومینیوم از عمری طولانی و نامحدود برخوردار است و دوام و پایداری آن از سایر مواردی که در اطرافمان هر روز میبینیم بیشتر است.
آلومینیوم نصب شده در گنبد کلیسای San RomesGieacchino در یک قرن پیش، اجزاء ساختمانی نصب شده در ساختمان امپراطوری نیویورک در سال 1953 (اولین ساختمانی که از آلومینیوم آندایز شده در آن استفاده شد) و یا مجسمه واقع در سیرک لندن
که قدمت آن به صد سال پیش بر میگردد، نمونههای جالبیست که نشان از عمر
طولانی این فلز دارند. آلومینیوم رطوبت را جذب نمی کند، متورم نمیشود، ترک
نمیخورد، شکافته و پاره نمیشود، منقبض نمیشود و قابل فاسد شدن نیست.
آلومینیوم در مقابل اشعه ماوراء بنفش به هیچ گونه پوششی نیاز ندارد.
محصولات
مصرفی آلومینیوم در ساختمان به صورت آلیاژهای آلومینیوم میباشند که به
صورت ریختگی یا فولادی بوده و حاوی عناصری مثل منگنز، منیزیم و سیلیسیم
میباشند. وجود این عناصر به صورت آلیاژی باعث یجاد خواص پایداری و دوام و
مقاومت در برابر اتمسفر و هوا و استحکام بالا تاحد فولاد میشود.
یکی
دیگر از خواص فوقالعاده آلومینیوم مقاومت خوردگی آن است. اکسید طبیعی که
همواره در سطح آلومینیوم وجود دارد مانع و سد بزرگی در برابر انواع مواد
خورنده محسوب میشود. لایه اکسید تشکیل شده، نازک، مستحکم و غیر متخلخل است
و نقش پوشش را بازی میکند. لذا در ساخت اجزایی از ساختمان که تنها یک بار
قابل چک کردن هستند و بعد از آن امکان بازدید آنها وجود ندارد، مناسب
میباشد. آلومینیوم در برابر رطوبت و اتمسفر هوا مقاوم است و خورده
نمیشود، لذا بهترین ماده برای ساخت در و پنجره و سایر تجهیزات ساختمانی در
مناطق مرطوب و شرجی و نواحی ساحلی است. علاوه بر آن مواد آلوده کنندهای
مثل آمونیوم NH4، منوکسید کربن و دیاکسید کربن تاثیر بسیار کمی بر
آلومینیوم دارند. همچنین تاثیر کمی که کلرید سدیم بر آلومینیوم دارد باعث
استفاده این فلز در سازههای دریایی و مناطق ساحلی گشته است. فویلهای
آلومینیومی معمولاً برای محافظت از سایر مواد ساختمانی به کار میروند.
مثلاً فویل به پانلهای ساختمانی "لامینه" چسبانده میشود و همچون یک پوشش
از نفوذ رطوبت به آن جلوگیری میکند.

آلومینیوم فلزی است که آندایز میشود،
یعنی آلومینیوم به عنوان آند قرار گرفته با اعمال جریان الکتریکی، یک لایه
اکسید بر سطح آن ایجاد میکنند که ضخامت این لایه بیشتر از لایه اکسید
طبیعی است و در ضمن به آلومینیوم قابلیت رنگپذیری میدهد.
طی
پروسه آندایزینگ میتوان آلومینیوم را به رنگهای زیبایی در آورد و به آن
زیبایی و استحکام بخشید، در نتیجه طرحی زیبا و جذاب تولید میشود که سطح آن
به آسانی با آب گرم قابل شتشو است و نیاز به هیچ تمیزکاری و نگهداری ندارد
و به طور طبیعی مقاوم به خوردگی است.
فلز آلومینیوم
کاربرد آلومینیوم
آلومینیوم عنصر شیمیایی است که در جدول تناوبی دارای علامت AL و عدد اتمی 13 می باشد آلومینیوم که عنصری نقره ای و انعطاف پذیر است عمدتأ به صورت سنگ معدن بوکسیت یافت می شود و از نظر مقاومتی که در برابر اکسیدا سیون دارد همچنین وزن و قدرت آن قابل توجه است. آلومینیوم در صنعت برای تولید میلیونها محصول مختلف به کار می رود و در جهان اقتصاد عنصر بسیار مهمی است. اجزای سازه هایی که از آلومینیوم ساخته می شوند در صنعت هوانوردی و سایر مراحل حمل و نقل بسیار مهم هستند نِیز سازه هایی که در آنها وزن ِ پایداری و مقاومت لازم است وجود این عنصر اهمیت زیادی دارد.
ویژگیهای قابل توجه
آلومینیوم
فلزی نرم ِ سبک اما قوی است با ظاهری نقره ای – خاکستری مات و لایه نازک
اکسیداسیون که در اثر برخورد با هوا در سطح آن تشکیل می شود از زنگ خوردگی
بیشتر جلوگیری می کند.وزن آلومینیوم تقریبأ یک سوم فولاد یا مس است ِ چکش خوار ِ انعطاف پذیر و به راحتی خم می شود ِ همجنین بسیار با دوام و مقاوم در برابر زنگ خوردگی است.
بعلاوه این عنصر غیر مغناطیسی ِ بدون جرقه ِ دومین فلز جکش خوار و ششمین فلز انعطاف پذیر است.
کاربردها
جه از نظر کیفیت و چه از نظر ارزش آلومینیوم کاربردی ترین فلز بعد از آهن است
وتقریبأ در تمامی بخشهای صنعت دارای اهمیت می باشد. آلومینیوم خالص نرم
وضعیف است اما می تواند آلیاژهایی را با مقادیر کمی از مس ِ منیزیوم ِ
منگنز ِ سیلیکن و دیگر عناصر بوجود آورد که این آلیاژ ها ویژگیهای مفید
گوناگونی دارند.
این آلیاژها اجزای مهم هواپیماها و راکتها را می سازند . وقتی آلومینیوم
را در خلا تبخیر کنند پوششی تشکیل می دهد که هم نور مرئی و هم گرمای تابشی
را منعکس می کند. این پوششها لایه نازک اکسید آلومینیوم محافظ را بوجود می
آورند که همانند پوششهای نقره خاصیت خود را از دست نمی دهند. یکی دیگر از موارد استفاده از این فلز در لایه آینه های تلسکوپهای نجومی است.
برخی از کاربردهای فراوان آلومینیوم عبارتند از :
- حمل و نقل «اتومبیلها ِ هواپیماها ِ کامیونها ِ کشتی ها ِ ناوگانهای دریایی ِ راه آهن و …)
- بسته بندی«قوطیها ِ فویل و…)
- ساختمان«درب ِ پنجره ِ دیوار پوشها و …)
- کالاهای با دوام مصرف کننده(وسلیل برقی خانگی ِ وسایل آشپزخانه ِ …)
- خطوط انتقال الکتریکی (به علت وزن سبک اگرجه هدایت الکترِکی آن تنها 60% هدایت الکتریکی مس می باشد)
- ماشین آلات
اکسید آلومینیوم «آلومینا) بطور طبیعی وبصورت کوراندوم ِ سنگ سمباده (emery) ِ یاقوت (ruby) و یاقوت کبود (sapphire) ِافت می شود که در صنعت شیشه سازی کاربرد دارد.یاقوت و یاقوت کبود مصنوعی در لیزر برای تولید نور هم نوسان بکار می روند . آلومینیوم با انرژی زیادی اکسیده می شود و در نتیجه در سوخت موشکهای با سوخت و دمازاها مورد استفاده واقع می شود.
تاریخچه
فردریک و هلر بطور کلی به آلومینیوم خالص اعتقاد داشت «لاتین :alum , alumen) .اما این فلز دو سال پیشتر بوسیله هانس کریستین ارستد شیمیدان و فیزیکدان دانمارکی بدست آمد.
در روم و یونان باستان این فلز را بعنوان ثابت کننده رنگ در رنگرزی و نیز
بعنوان بند آورنده خون در زخمها بکار می بردند وهنوز هم بعنوان داروی بند
آورنده خون مورد استفاده است. در سال 1761 گویتون دموروو پیشنهاد کرد تا alum را آلومین (alumin) بنامند.
پیدایش و منابع
اگر چه AL یک عنصر فراوان در پوسته زمین است(1ِ8%) ِ این عنصر در حالت آزاد خود بسیار نادر است و زمانی یک فلز گرانبها و ارزشمندتر از طلا به
حساب می آمد.بنابر این بعنوان فلزی صنعتی اخیرأ مورد توجه قرار گرفته ودر
مقیاسهای تجاری تنها بیش از 100 سال است که مورد استفاده است.
در ابتدا که این فلز کشف شد جدا کردن آن از سنگها بسیار مشکل بود و چون کل
آلومینیوم زمین بصورت ترکیب بود مشکل ترین فلز از نظر تهیه به شمار می آمد.
آلومینیوم برای مدتی از طلا با ارزش تر بود اما بعد از ابداع یک روش آسان برای استخراج آن در سال 1889 قیمت آن رو به کاهش گذاشت و سقوط کرد.تهیه مجدد این فلز از قطعات اسقاط (از طریق بازیافت) تبدیل
به بخش مهمی از صنعت آلومینیوم شد.بازیافت آلومینیوم موضوع تازه ای نیست
بلکه از قرن نوزدهم یک روش رایج برای این کار وجود داشت. با اینهمه تا
اواخر قرن دهه 60 این یک کار کم منفعتی بود تا زمانیکه بازیافت قوطیهای
آلومینیومی آشامیدنیها بالاخره بازیافـت این فلز را مورد توجه قرار
داد.منابع بازیافت آلومینیوم عبارتند از: اتومبیلها ِ پنجره ها ِ دربها ِ
لوازم منزل ِ کانتینرها و سایر محصولات …
آلومینیوم یک فلز واکنشگر است و نمی تواند از سنگ معدن خود بوکسیت (Al2o) بوسیله کاهش با کربن جدا
شود.در عوض روش جدا سازی این فلز از طریق الکترولیز است.(این فلز در محلول
اکسیده شده سپس بصورت فلز خالص جدا می شود.) لذا جهت این کار سنگ معدن
باید درون یک مایع قرار بگیرد.اما بوکسیت دارای نقطه ذوب بالایی است (c2000) که
تامین این مقدار انرﮊی از نظر اقتصادی مقرون به صرفه نیست . برای سالهای
زیادی بوکسیت را در فلورید سدیم و آلومینیوم مذاب قرار می دادند و نقطه ذوب
آن تا c900 کاهش می یافت.اما امروزه مخلوط مصنوعی
ازآلومینیوم ِ سدیم و فلوریدکلسیم جایگزین فلورید سدیم و آلومینیوم شده
است. این فرایند هنوز مستلزم انرژی بسیار زیاد است و کارخانجات آلومینیوم
دارای ایستگاههای برق مخصوص خود در اطراف این کارخانه ها هستند.
الکترودهایی که در الکترولیز بوکسیت بکار می روند هر دو کربن هستند. وقتی سنگ معدن در حالت مذاب است یونهای آن آزادانه حرکت می کنند. واکنش در کاتد منفی اینگونه است:
Al3++3e -Al
در اینجا یون آلومینیوم در حالت کاهش است(الکترونها اضافه می شوند) سپس فلز آلومینیوم به سمت پایین فرو می رود و خارج می شوند.
آند مثبت اکسیژن بوکسیت را اکسیده می کند که بعد از آن با الکترود کربنی واکنش کرده تا تولید دی اکسید کربن نماید.
این کاتد باید عوض شود چون اغلب تبدیل به دی اکسید کربن می شود.بر خلاف هزینه الکترولیز ِ آلومینیوم فلزی ارزان با کاربرد وسیع است. امروزه آلومینیوم را می توان از خاکه معدنی(clay) استخراج کرد اما این فرایند اقتصادی نیست.
ایزوتوپها
آلومینیوم دارای 9 ایزوتوپ است که عمده ترین آنها بین 23 تا 30 مرتب شده اند. تنها AL-27 «ایزوتوپ پایدار) و AL-26 (ایزوتوپ رادیو اکتیو) بطور طبیعی وجود دارند.AL-26 از پراشیدن ذرات اتم آرگون در اتمسفر که در نتیجه پروتونهای اشعه کیهانی رخ می دهد تولید می شود. ایزوتوپهای آلومینیوم کاربردهای عملی در تعیین قدمت رسوبات دریایی ِ سختگاه منگنز ِ یخهای دوران یخبندان ِ کوارتز در صخره ها شهاب سنگها دارد.
نسبت AL-26 به برلیوم 10 برای 5 مطالعه 6 نقش حمل ِ ته نشینی ِ ذخیره رسوب ِ زمان دفن و فرسایش در مقیاس زمانی 10 تا 10 بکار برده شده است.
AL-26«Cosmogenic) اوْطن بار در مطالعات ماه و
شهاب سنگها بکار رفت. اجزاء شهاب سنگها بعد از جدا شدن از پیکره مادر در
مدت سفر خود در فضا در معرض شدید بمباران اشعه کیهانی هستند که باعث تولید
آلومینیوم 27 پایدار می شود. بعد از سقوط روی زمین حفاظ اتمسفر مانع از
تولید AL-26 بیشتر از قطعات شهاب سنگها می شود و واپاشی آن در تعیین عمر زمینی آنها موتر است.تحقِقات روی شهاب سنگها ثابت کرده AL-26 در زمان شکل گیری سیاره ما نسبتا به مقدار فراوان وجود داشته است. احتمالا انرژی آزاد شده در نتیجه واپاشی AL-26 ِ ذوب شدن مجدد و جدایی سیارکها بعد از شکل گیری آنها را 2-4 میلیارد سال پیش در پی داشته است.
تولید صنعتی آلومینیوم
آلومینیوم فلزی پرمصرف است که عنصر دوم از گروه سوم جدول تناوبی میباشد. آلومینیوم (Al) دومین عضو از گروه سوم جدول تناوبی ، فلزی است که در کشور ما تولید میشود و در میان عنصرهای فلزی هم گروه خود بیشترین اهمیت را دارد. آلومینیوم به حالت آزاد در طبیعت یافت نمیشود، اما ترکیبهای آن فراوان است. آلومینیوم بعد از اکسیژن و سیلیسیم فراوانترین عنصر در پوسته زمین است.
پیوند در ترکیبهای آلومینیوم
مهمترین کانی آلومینیوم ، بوکسیت است که اکسید آلومینیوم آبپوشیده میباشد و برای تهیه فلز از این کانی استفاده میشود. چگالی بار (نسبت بار به شعاع) برای یون Al+3 به علت داشتن بار زیاد و کوچک بودن شعاع آن ، زیاد است. میدانیم که الکترونها اعم از از اینکه پیوندی باشند یا به صورت زوج تنها ، پیوسته در فضایی که در اختیار دارند، در حرکت هستند و اغلب ، الکترونها را به صورت ابری با بار منفی مجسم میکنیم.
این ابر بار میتواند بوسیله یک میدان الکتریکی که در مجاورت آن قرار دارد، از حالت کروی خارج شده، به سمت یک بار مثبت کشیده یا بوسیله یک بار منفی رانده شود. درجه سهولت واپیچش ابر الکترونی یک ذره را قطبشپذیری آن مینامند. قطبشپذیری اتمها یا یونهای کوچکتر کمتر از اتمها یا یونهای برزگتر است، زیرا در اتمها یا یونهای کوچکتر ، الکترونها به هسته نزدیکترند و اتصال آنها با هسته محکمتر است. آلومینیوم در ترکیبهای خود با از دست دادن هر سه الکترون ظرفیت ، عدد اکسایش 3+ بدست میآورد.
اما یون Al+3 با توجه به اندازه کوچک و بار زیادی که دارد، میتواند به راحتی باعث قطبش ابر بار هر آنیونی که با آن در تماس است، شود و آن آنیون را به سمت خود بکشد و در فضای بین یون آلومیینوم و آنیون ، ابر الکترونی قابل ملاحظهای پدید میآید که نشانهای از پیدایش خصلت کووالانسی در پیوند است. به این ترتیب ، پیوند آلومینیوم با آنیونهایی نظیر -Br و -I که قطبشپذیری آنها بیشتر است، به صورت کووالانسی توصیف میشود. اثر قطبش یون Al+3 را روی هالیدها میتوان با مقایسه خواص هالیدهای آلومینیوم دریافت.
اکسید آلومینیوم (Al2O3)
اکسید آلومینیوم را معمولا یک ترکیب یونی در نظر میگیریم، اما به علت قطبشپذیری یونهای اکسید بوسیله یونهای Al+3 پیوند آلومینیوم و اکسیژن تا حدودی خصلت کووالانسی دارد. برهمکنش الکتروستاتیک بین یونهای کوچک آلومینیوم و اکسیژن از یک طرف و پیدایش خصلت کووالانسی از طرف دیگر ، سبب شده که پیوند بین این یونها در اکسید آلومینیوم بسیار قوی باشد. این اکسید در دمای 205 درجه سانتیگراد ذوب میشود و در آب نامحلول است. اکسید آلومینیوم در طبیعت به دو صورت آبپوشیده و بی آب یافت میشود. شکل آبپوشیده آن بوکسیت نام دارد. سنگ سنباده و «کوراندوم» شکل بی آب آن است.
کوراندوم جسمی سخت و متبلور است و با جایگزین شدن مقدار کمی از یونهای فلزهای واسطه به جای یونهای آلومینیوم در این بلور ، سنگهای قیمتی مانند یاقوت قرمز یا یاقوت کبود بدست میآید. یاقوت قرمز که در لیزر هم از آن استفاده میشود، شامل مقدار جزئی Cr+3 و یاقوت کبود شامل Fe+3 و (Ti(IV است. رنگ این سنگها ناشی از وجود این یونهای فلزات واسطه است. از اکسید آلومینیوم به خاطر داشتن ساختاری پایدار و فوقالعاده سخت در تهیه سیمان ، آجرهای دیرگداز کورهها و سطح بیاثر کاتالیزور در کراکنیگ برشهای نفتی استفاده میشود.
استخراج آلومینیوم
آلومینیوم در صنعت بوسیله الکترولیز اکسید آلومینیوم مذاب تهیه میشود. اکسید آلومینیوم از بوکسیت که اکسید آلومینیوم آبپوشیده و ناخالص است، بدست میآید. ناخالصیهای بوکسیت بطور عمده ، هماتیت و سیلیس است. برای جداسازی آلومینیوم با توجه به خصلت بازی اکسید آهن (III) ، خصلت اسیدی «اکسید سیلسیم» (سیلیس) و خصلت آمفوتری اکسید آلومینیوم از سود سوزآور استفاده میکنند. اکسید آلومینیوم و سیلیس در محلول غلیظ سود حل میشوند. اکسید آهن (III) را بوسیله صافی جدا میکنند، سپس دیاکسید کربن را از محلول عبور میدهند. دیاکسید کربن با آب ، اسید ضعیف «اسید کربنیک» را تشکیل میدهد.
بدین ترتیب ، اکسید آلومینیوم رسوب میکند و یون سیلیکات در محلول باقی میماند. اکسید آلومینیوم را در کریولیت مذاب (Na3AlF6) که دمای ذوب آن از اکسید آلومینیوم کمتر است، حل میکنند. دمای الکترولیت مذاب حدود 850 درجه سانتیگراد است. یون AL+3 در کاتد سلول الکترولیز که از جنس گرافیت است، کاهش یافته، به صورت آلومینیوم مذاب در ته سلول جمع میشود. در آند نیز اکسیژن آزاد میشود. آند نیز از جنس گرافیت است. اکسیژن در دمای زیاد با کربن ترکیب شده ، اکسیدهای کربن تشکیل میدهد. از این رو ، آند میسوزد و هرچند مدت یک بار آن را تعویض میکنند.
موارد استفاده آلومینیوم
آلومینیوم یکی از فلزهای ساختمانی است و آن را با فلزهای مختلف به صورت آلیاژ در میآورند و در صنایع هواپیما سازی ، موتور اتومبیل و ساخت در و پنجره بکار میبرند. همچنین ، آلومینیوم برای ساخت قوطیهای نوشابه مورد استفاده قرار میگیرد. همچنین آلومینیوم برای تولید فویلهای آلومینیومی مورد استفاده قرار میگیرد.
هزینه تولید آلومینیوم و مشکلات زیست محیطی
منابع
آلومینیوم در طبیعت از منابع تجدیدناپذیر به شمار میآیند. به این معنا
که طبیعت راهی برای تولید مجدد این منبع ندارد. از طرف دیگر ، تولید
آلومینیوم به مصرف الکتریکی بسیار زیادی نیاز دارد. با توجه به اینکه آلومینیوم مصرفی
سرانجام به صورت زباله به طبیعت راه پیدا میکند، مساله بازگردانی
آلومینیوم از نظر حفظ محیط زیست حائز اهمیت و از نظر اقتصادی نیز مقرون به
صرفه است. مثلا هزینه لازم برای جمعآوری قوطیهای نوشابه ، انرژی الکتریکی مصرفی برای ذوب این قوطیها و ساخت مجدد آنها حدود 5 درصد هزینه استخراج آلومینیوم از بوکسیت است. انجام این کار
به حفظ طولانیتر منابع بوکسیت
به حفظ منابع سوختهای فسیلی که باید برای تولید انرژی الکتریکی مورد نیاز کارخانههای تولید آلومینیوم بکار رود.
به کاهش مواد آلایندهای که در نتیجه احتراق سوختهای فسیلی در فضا پراکنده میشوند.
و در نهایت به حفظ محیط زیست کمک میکند
فلز آلومینیوم
تاریخچه کشف آلومینیوم
"فردریک وهلر" بطور کلی به آلومینیوم خالص اعتقاد داشت .(لاتین :alum alumen). اما این فلز دو سال پیشتر بوسیله "هانس کریستین ارستد" شیمیدان و فیزیکدان دانمارکی بدست آمد. در روم و یونان باستان این فلز را بعنوان ثابت کننده رنگ در رنگرزی و نیز بعنوان بند آورنده خون در زخمها بکار میبردند و هنوز هم بعنوان داروی بند آورنده خون مورد استفاده است. در سال 1761 ، "گویتون دموروو" پیشنهاد کرد تا alum را آلومین (alumin) بنامند.پیدایش و منابع
اگر چه Al ، یک عنصر فراوان در پوسته زمین است(18%) ، این عنصر در حالت آزاد خود بسیار نادر است و زمانی یک فلز گرانبها و ارزشمندتر از طلا به حساب میآمد. بنابراین ، بعنوان فلزی صنعتی اخیرأ مورد توجه قرار گرفته و در مقیاسهای تجاری تنها بیش از 100 سال است که مورد استفاده است. در ابتدا که این فلز کشف شد، جدا کردن آن از سنگها بسیار مشکل بود و چون کل آلومینیوم زمین بصورت ترکیب بود، مشکلترین فلز از نظر تهیه به شمار میآمد.

|
آلومینیوم برای مدتی از طلا با ارزشتر بود، اما بعد از ابداع یک روش آسان برای استخراج آن در سال 1889 ، قیمت آن رو به کاهش گذاشت و سقوط کرد. تهیه مجدد این فلز از قطعات اسقاط (از طریق بازیافت) تبدیل به بخش مهمی از صنعت آلومینیوم شد. بازیافت آلومینیوم موضوع تازه ای نیست، بلکه از قرن نوزدهم یک روش رایج برای این کار وجود داشت. با اینهمه تا اواخر دهه 60 این یک کار کم منفعتی بود تا زمانیکه بازیافت قوطیهای آلومینیومی آشامیدنیها بالاخره بازیافـت این فلز را مورد توجه قرار داد. منابع بازیافت آلومینیوم عبارتند از: اتومبیلها ، پنجره ها ، درها ، لوازم منزل ، کانتینرها و سایر محصولات ... .
معرفی
آلومینیوم ، عنصر شیمیایی است که در جدول تناوبی دارای علامت Al و عدد اتمی 13 میباشد. آلومینیوم که عنصری نقرهای و انعطافپذیر است، عمدتأ به صورت سنگ معدن بوکسیت یافت میشود و از نظر مقاومتی که در برابر اکسیداسیون دارد، همچنین وزن و قدرت آن ، قابل توجه است. آلومینیوم در صنعت برای تولید میلیونها محصول مختلف بکار میرود و در جهان اقتصاد ، عنصر بسیار مهمی است.اجزای سازههایی که از آلومینیوم ساخته میشوند، در صنعت هوانوردی و سایر مراحل حمل و نقل بسیار مهم هستند. همچنین در سازههایی که در آنها وزن پایداری و مقاومت لازم هستند، وجود این عنصر اهمیت زیادی دارد.
ویژگیهای قابل توجه
آلومینیوم ، فلزی نرم و سبک ، اما قوی است، با ظاهری نقرهای - خاکستری مات و لایه نازک اکسیداسیون که در اثر برخورد با هوا در سطح آن تشکیل میشود، از زنگ خوردگی بیشتر جلوگیری میکند. وزن آلومینیوم تقریبأ یک سوم فولاد یا مس است.ِ چکش خوار ، انعطاف پذیر و به راحتی خم میشود. همچنین بسیار بادَوام و مقاوم در برابر زنگ خوردگی است. بعلاوه ، این عنصر غیر مغناطیسی ، بدون جرقه ، دومین فلز چکش خوار و ششمین فلز انعطافپذیر است.کاربردها
چه از نظر کیفیت و چه از نظر ارزش ، آلومینیوم کاربردیترین فلز بعد از آهن است و تقریبأ در تمامی بخشهای صنعت دارای اهمیت میباشد. آلومینیوم خالص ، نرم و ضعیف است، اما میتواند آلیاژهایی را با مقادیر کمی از مس ، منیزیوم ، منگنز ، سیلیکون و دیگر عناصر بوجود آورد که این آلیاژها ویژگیهای مفید گوناگونی دارند. این آلیاژها اجزای مهم هواپیماها و راکتها را میسازند.وقتی آلومینیوم را در خلاء تبخیر کنند، پوششی تشکیل میدهد که هم نور مرئی و هم گرمای تابشی را منعکس میکند. این پوششها لایه نازک اکسید آلومینیوم محافظ را بوجود میآورند که همانند پوششهای نقره خاصیت خود را از دست نمیدهند. یکی دیگر از موارد استفاده از این فلز در لایه آینههای تلسکوپهای نجومی است.
برخی از کاربردهای فراوان آلومینیوم عبارتند از:
- حمل و نقل ( اتومبیلها ، هواپیماها ، کامیونها ، کشتیها ، ناوگانهای دریایی ، راه آهن و ... )
- بستهبندی ( قوطیها ، فویل و... )
- ساختمان ( درب ، پنجره ، دیوار پوشها و ... )
- کالاهای با دوام مصرف کننده ( وسایل برقی خانگی ، وسایل آشپزخانه ، ... )
- خطوط انتقال الکتریکی ( بهعلت وزن سبک اگرچه هدایت الکترِکی آن تنها 60% هدایت الکتریکی مس میباشد )
- ماشین آلات
استخراج آلومینیوم
آلومینیوم یک فلز واکنشگر است و نمیتواند از سنگ معدن خود بوکسیت (Al2O ) بوسیله کاهش با کربن جدا شود. در عوض روش جداسازی این فلز از طریق الکترولیز است. (این فلز در محلول اکسیده شده ، سپس بصورت فلز خالص جدا میشود.) لذا جهت این کار ، سنگ معدن باید درون یک مایع قرار بگیرد. اما بوکسیت دارای نقطه ذوب بالایی است (2000 درجه سانتیگراد) که تامین این مقدار انرﮊی از نظر اقتصادی مقرون به صرفه نیست.برای سالهای زیادی بوکسیت را در فلورید سدیم و آلومینیوم مذاب قرار میدادند و نقطه ذوب آن تا 900درجه سانتیگراد کاهش مییافت. اما امروزه مخلوط مصنوعی ازآلومینیوم ، سدیم و فلوئورید کلسیم ، جایگزین فلورید سدیم و آلومینیوم شده است. این فرایند هنوز مستلزم انرژی بسیار زیاد است و کارخانجات آلومینیوم دارای ایستگاههای برق مخصوص خود در اطراف این کارخانهها هستند.
الکترودهایی که در الکترولیز بوکسیت بکار میروند، هر دو کربن هستند. وقتی سنگ معدن در حالت مذاب است، یونهای آن آزادانه حرکت میکنند. واکنش در کاتد منفی اینگونه است:
در اینجا یون آلومینیوم در حالت کاهش است(الکترونها اضافه میشوند). سپس فلز آلومینیوم به سمت پایین فرو میرود و خارج میشود.
آند مثبت ، اکسیژن بوکسیت را اکسیده میکند که بعد از آن با الکترود کربنی واکنش کرده تا تولید دیاکسید کربن نماید.
این کاتد باید عوض شود، چون اغلب تبدیل به دیاکسید کربن میشود. بر خلاف هزینه الکترولیز ، آلومینیوم فلزی ، ارزان با کاربرد وسیع است. امروزه آلومینیوم را میتوان از خاکه معدنی (clay) استخراج کرد، اما این فرایند ، اقتصادی نیست.
ایزوتوپها
آلومینیوم ، دارای 9 ایزوتوپ است که عمدهترین آنها بین 23 تا 30 مرتب شدهاند. تنها Al-27 ( ایزوتوپ پایدار ) و AL-26 (ایزوتوپ رادیو اکتیو) بطور طبیعی وجود دارند. AL-26 از پراشیدن ذرات اتم آرگون در اتمسفر که در نتیجه پروتونهای اشعه کیهانی رخ میدهد، تولید میشود. ایزوتوپهای آلومینیوم ، کاربردهای عملی در تعیین قدمت رسوبات دریایی ، خاستگاه منگنز ، یخهای دوران یخبندان ، کوارتز در صخرهها و شهاب سنگها دارد.AL-26 اولین بار در مطالعات ماه و شهابسنگها بکار رفت. اجزاء شهابسنگها بعد از جدا شدن از پیکره مادر در مدت سفر خود در فضا در معرض شدید بمباران اشعه کیهانی هستند که باعث تولید آلومینیوم 27 پایدار میشود. بعد از سقوط روی زمین ، حفاظ اتمسفر مانع از تولید AL-26 بیشتر از قطعات شهابسنگها میشود و واپاشی آن در تعیین عمر زمینی آنها موثر است. تحقیقات روی شهابسنگها ثابت کرده است که AL-26 در زمان شکلگیری سیاره ما نسبتا به مقدار فراوان وجود داشته است. احتمالا انرژی آزاد شده در نتیجه واپاشی AL-26 ، ذوب شدن مجدد و جدایی سیارکها بعد از شکل گیری آنها را 2-4 میلیارد سال پیش در پی داشته است.
املاء
املاء رسمی این عنصر ، IUPAK) Aluminium) است، گرچه عموما آمریکاییها و کاناداییها آنرا بصورت Aluminum نوشته و تلفظ میکنند. "همفری دیوی" در سال1807 Aluminum را برای عنصر کشف شده در آن زمان ارائه کرد، اما بعدا تصمیم گرفت تا این نام را به Aluminium تغییر دهد که با وجود ium در نام بیشتر عناصر تطبیق کند. بعدها املا Aluminium در بریتانیا و آمریکا متداول شد، اما بعد بتدریج آمریکاییها برای اهداف غیرتخصصی این نام را به Aluminum برگرداندند. نام رسمی این عنصر در آمریکا و در رشته شیمی تا سال 1926 بصورت Aluminium بکار رفت. از این تاریخ به بعد انجمن شیمی آمریکا تصمیم به استفاده از املاء Aluminum در نشرِات خود گرفت.
| |||||||||||||||||||
| عمومی | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| نام , علامت اختصاری , شماره | Aluminium , Al , 13 | ||||||||||||||||||
| گروه , تناوب , بلوک | 13 IIIA , 3 , بلوک p | ||||||||||||||||||
| جرم حجمی , سختی | 2700 kg/m3 , 2.75 | ||||||||||||||||||
| رنگ | نقره ای | ||||||||||||||||||
| خواص اتمی | |||||||||||||||||||
| وزن اتمی | 26.981538 amu | ||||||||||||||||||
| شعاع اتمی (calc.) | 125 (118) pm | ||||||||||||||||||
| شعاع کووالانسی | 118 pm | ||||||||||||||||||
| شعاع وندروالس | اطلاعات موجود نیست | ||||||||||||||||||
| ساختار الکترونی | Ne]3 s2 3p1] | ||||||||||||||||||
| -e بازای هر سطح انرژی | 2, 8, 3 | ||||||||||||||||||
| درجه اکسیداسیون اکسید | 3 (آمفوتریک) | ||||||||||||||||||
| ساختار کریستالی | مکعبی face centered | ||||||||||||||||||
| خواص فیزیکی | |||||||||||||||||||
| حالت ماده | جامد | ||||||||||||||||||
| نقطه ذوب | 933.47 K (1220.58 °F) | ||||||||||||||||||
| نقطه جوش | 2792 K (4566 °F) | ||||||||||||||||||
| حجم مولی | 10.00 ש»10-6 ««متر مکعب بر مول | ||||||||||||||||||
| گرمای تبخیر | 293.4 kJ/mol | ||||||||||||||||||
| گرمای هم جوشی | 10.79 kJ/mol | ||||||||||||||||||
| فشار بخار | 2.42 E-06 Pa at __ K | ||||||||||||||||||
| سرعت صوت | 5100 m/s at 933 K | ||||||||||||||||||
| متفرقه | |||||||||||||||||||
| الکترونگاتیوته | 1.61 درجه پائولینگ | ||||||||||||||||||
| ظرفیت گرمایی ویژه | 900 J/kg*K | ||||||||||||||||||
| رسانائی الکتریکی | 37.7 106/m اهم | ||||||||||||||||||
| رسانائی گرمایی | 237 W/m*K | ||||||||||||||||||
| 1st پتانسیل یونیزاسیون | 577.5 kJ/mol | ||||||||||||||||||
| 2nd پتانسیل یونیزاسیون | 1816.7 kJ/mol | ||||||||||||||||||
| 3rd پتانسیل یونیزاسیون | 2744.8 kJ/mol | ||||||||||||||||||
| 4th پتانسیل یونیزاسیون | 11577 kJ/mol | ||||||||||||||||||
| 5th پتانسیل یونیزاسیون | 14842 kJ/mol | ||||||||||||||||||
| 6th پتانسیل یونیزاسیون | 18379 kJ/mol | ||||||||||||||||||
| 7th پتانسیل یونیزاسیون | 23326 kJ/mol | ||||||||||||||||||
| 8th پتانسیل یونیزاسیون | 27465 kJ/mol | ||||||||||||||||||
| 9th پتانسیل یونیزاسیون | 31853 kJ/mol | ||||||||||||||||||
| 10th پتانسیل یونیزاسیون | 38473 kJ/mol | ||||||||||||||||||
| پایدارترین ایزوتوپها | |||||||||||||||||||
| |||||||||||||||||||
فلز آهن
مقدمه :
آهن عنصرشیمیایی است که در جدول تناوبی با نشان Fe و عدداتمی26 وجود دارد، آهن فلزی است که در گروه 8 و دوره 4 جدول تناوبی قرار دارد.
تاریخچـــــه :
اولین نشانههای استفاده از آهن به زما ن سومریان و مصریان بر می گردد که تقریبا" 4000 سال قبل از میلاد با آهن کشف شده از شهاب سنگ ها اقلام کوچکی مثل: سر نیزه و زیور آلات می ساختند. از 3000 -2000 سال قبل از میلاد ، تعداد فزاینده ای از اشیاء ساخته شده با آهن مذاب ( فقدان نیکل ،این محصولات را از آهن شهاب سنگی متمایز میکند ) در بین النهرین، آسیا ی صغیر و مصر به چشم میخورد، اما ظاهرا" تنها در تشریفات از آهن استفاده می شد و آهن فلزی گرانبها حتی باارزشتر از طلا بهحساب میآمد.
براساس تعدادی ازمنابع، آهن به عنوان یک محصول جانبی از تصفیه مس تولید می شده مثل آهن اسفنجی و به وسیله ی متالوژی آن زمان قابل تولید مجدد نبوده است . از 1600- 1200 سال قبل از میلاد درخاورمیانه به طور روز افزون از این فلز استفاده میشد، اما جایگزین کابرد برنز درآن زمان نشد.
تبر آهنی متعلق به عصر آهن سوئد در گاتلند سوئد یافت شده است. از قرن 12- 10 در خاورمیانه یک جابه جایی سریع در تبدیل ابزار و سلاح های برنزی به آهنی صورت گرفت. عامل مهم در این جابه جایی ، آغازناگهانی تکنولوژی های پیشرفته ی کار با آهن نبود، بلکه عامل اصلی مختل شدن تامین قلع بود. این دوره جابجایی که در زمان های مختلف و در نقاط مختلفی از جهان رخ داد، دوره ای از تمدن به نام عصرآهن را به وجود آورد،هم زمان با جایگزینی آهن به جای برنز ، فرآیند کربوریزاسیونگ ( کربن دارکردن )کشف شد که بوسیله ی آن به آهن موجود در آن زمان ، کربن اضافه میکردند.
آهن را به صورت اسفنجی
که مخلوطی از آهن به همراه مقداری کربن یا کاربید است، بازیافت کردند. سپس
اضافات آن را با چکشکاری جدا نموده ومحتوی کربن را اکسید میکردند تا
بدین طریق آهن نرم را تولید کنند.
مردم خاورمیانه دریافتند که با حرارت
دادن طولانی مدت آهن نرم در لایه ای از ذغال و آب دادن آن در آب یا روغن
میتوان محصولی بسیار محکم تر بدست آورد. محصول حاصله که دارای سطح فولادی
است، از برنزی که قبلا" کاربرد داشت محکم تر و مقاوم تربود.
درچین نیز اولین بار از آهن شهاب سنگی استفاده شد و اولین شواهد باستان شناسی برای اقلام ساخته شده با آهن نرم در شمال شرقی نزدیک Xinjiang مربوط به قرن 8 قبل از میلاد بدست آمده است. این وسایل از آهن نرم و با همان روش خاورمیانه و اروپا ساخته شده بودند و گمان می رفت که برای مردم غیر چینی هم ارسال می کردند.
درسال های آخر پادشاهی سلسله ژو (حدود 550سال قبل از میلاد) به سبب پیشرفت زیاد تکنولوژی کوره ، قابلیت تولید آهن جدیدی به وجود آمد. ساخت کورههای بلند ی که توانایی حرارتهای بالای k 1300 را داشت، موجب تولید آهن خام یا چدن توسط چینِیها شد. اگر سنگ معدن آهن را با کربن k 1420-1470 حرارت دهیم، مایع مذابی بدست میآید که آلیاژی با 5/96% آهن و 5/53% کربن است. این محصول محکم را می توان به شکل های ریز و ظریفی در آورد. اما برای استفاده بسیار شکننده میباشند، مگر آنکه بیشترکربن آن را از بین ببرند. از زمان سلسله ژو به بعد اکثر تولیدات آهن در چین به شکل چدن است. با این همه آهن به عنوان یک محصول عادی که برای صدها سا ل مورد استفاده کشاورزان قرار گرفته است، باقی ماند و تا زمان سلسله شین ( حدود 221سال قبل از میلاد ) عظمت چین را واقعا" تحت تاثیر قرار نداد.
توسعه چدن در اروپا
عقب افتاد، چون کورههای ذوب در اروپا فقط توانایی k 1000 را داشت. در بخش
زیادی از قرون وسطی در اروپای غربی آهن را همچنان با روش تبد یل آهن اسفنجی
به آهن نرم بدست میآوردند. تعدادی از قالبگیری های آهن در اروپا بین
سالهای 1350 - 1150 بعد از میلاد در دو منطقه در سوئد به نامهای Lapphyttan
و Vinarhyttan انجام شد. دانشمندان میپندارند شاید این روش بعد از این دو
مکان تا مغولستان آن سوی روسیه ادامه یافته باشد، اما دلیل محکمی برای
اثبات این فرضیه وجود ندارد. تا اواخر قرن نوزدهم در هر رویدادی یک بازار
برای کالاهای چدنی به وجود آمد، مانند: درخواست برای گلولههای توپ چدنی.
در
آغاز برای ذوب آهن از زغال چوب هم به عنوان منبع حرارتی و هم عامل کاهنده
استفاده میشد. در قرن 18 در انگلستان تامین کنندگان چوب کم شدند و از زغال
سنگ که یک سوخت فسیلی است، به عنوان منبع جانشین استفاده شد. این نوآوری
به وسیلـــه Abraham Darby انرژی لازم برای انقلاب صنعتی را تامین نمود.
پیدایـــــــش :
آهن یکی از رایجترین عناصر زمین است که تقریبا" 5% پوسته زمین را تشکیل میدهد. آهن از سنگ معدن هماتیت که عمدتا" Fe2O3 میباشد، استخراج میگردد. این فلز را بوسیله روش کاهش با کربن که عنصری واکنشپذیرتر است جدا میکنند. این عمل درکوره بلند در دمای تقریبا" 2000 درجه سانتی گراد انجام می پذیرد. در سال 2000 ، تقریبا" 1100 میلیون تن سنگ معدن آهن با رشد ارزش تجاری تقریبا" 25 میلیارد دلار آمریکا استخراج شد. درحالی که استخراج سنگ معدن آهن در 48 کشور صورت میگیرد، چین ، برزیل ، استرالیا ، روسیه و هند با تولید 70% سنگ آهن جهان پنج کشور بزرگ تولید کنندگان آن بهحساب میآیند. برای تولید تقریبا" 572 میلیون تن آهن خام 1100 میلیون تن سنگ آهن مورد نیاز است.
خصوصیات قابل توجه :
جرم یک اتم معمولی آهن 56 برابر جرم یک اتم معمولی هیدروژن می باشد. عقیده بر این است که آهن، دهمین عنصر فراوان در جهان است. Fe مخفف واژه لاتین ferrum برای آهن میباشد. این فلز، از سنگ معدن آهن استخراج میشود و به ندرت به حالت آزاد (عنصری) یافت میگردد.برای تهیه آهن عنصری ، باید ناخالصی های آن را با روش کاهش شیمیایی از بین برد. آهن برای تولید فولادبکار می رود که عنصر نیست، بلکه یک آلیاژو مخلوطی است از فلزات متفا وت ( و تعدادی غیر فلز بخصوص کربن ).
هسته اتم های آهن دارای بیشترین نیروی همگیر در هر نوکلئون هستند بنابراین آهن با روش هم جوشی ، سنگین ترین و با روش شکافت اتمی ، سبک ترین عنصری است که به صورت گرما زایی تولید می شود. وقتی یک ستاره که دارای جرم کافی می باشد چنین کاری انجام دهد، دیگر قادر به تولید انرژی در هستهاش نبوده و یک ابر اختر پدید میآید. آهن رایجترین فلز در جهان به حساب میآید. الگوهای جهان شناختی با یک جهان باز پیشبینی زمانی را میکند که در نتیجه واکنش های هم جوشی و شکافت هسته ای همه چیز به آهن تبدیل خواهد شد.
کاربردهــــــــــا :
کاربرد آهن از تمامی فلزات بیشتر است و 95 درصد فلزات تولید شده در سراسر جهان را تشکیل میدهد. قیمت ارزان و مقاومت بالای ترکیب آن، استفاده از آن را به خصوص در اتومبیل ها ، بدنه کشتیهای بزرگ و ساختمان ها اجتنا ب ناپذیر میکند. فولادمعروف ترین آلیاژ آهن است و تعدادی از گونههای آهن به شرح زیر میباشد:
آهن خام که دارای 5%-4% کربن و مقادیر متفاوتی ناخالصی هایی از قبیل گوگرد، سیلیکون و فسفراست و اهمیت آن فقط به این علت است که در مرحله ی میانی مسیر سنگ آهن تا چدن و فولادقرار دارد.
چدن ، شامل 5/3%-2% کربن و مقدار کمی منگنزمیباشد. ناخالصیهای موجود در آهن خام مانند:گوگرد و فسفر که خصوصیات آن را تحت تاثیر منفی قرار میدهد، در چدن تا حد قابل قبولی کاهش مییابند. نقطه ذوب چدن بین k 1420-1470 می باشد که از هر دو ترکیب اصلی آن کمتر است و آن را به اولین محصول ذوب شده پس ازگرم شدن هم زمان کربن و آهن تبد یل میکند. چدن بسیارمحکم ،سخت و شکننده میباشد. چدن مورد استفاده حتی چدن گرمای سفید موجب شکستن اجسام میشود.
فولاد کربن شامل 5/1% - 5/ 0% کربن و مقادیر کم منگنز، گوگرد ، فسفر و سیلیکون است.آهن ورزیده ( آهن نرم) دارای کمتر از 5/0% کربن میباشد و محصولی محکم و چکشخوار است، اما به اندازه آهن خام گدازپذیر نیست. حاوی مقادیر بسیار کمی کربن است ( چند دهم درصد). اگر یک لبه آن تیز شود، به سرعت تیزی خود را از د ست می دهد.
فولادهای آلیاژ حاوی مقادیر متفاوتی کربن به علاوه فلزات دیگرما نند:کروم، وانادیم، مولیبدن، نیکل، تنگستن و ... میباشد.
اکسیدهای آهن برای ساخت ذخیره مغناطیسی درکامپیوترمورد استفاده قرار میگیرند. آنها اغلب با ترکیبا ت دیگری مخلوط شده و خصوصیات مغناطیسی خود را به صورت محلول هم حفظ میکنند.
ترکیبات :
معمول ترین حالات اکسیداسیون آهن عبارتند از:
۱- حالت فروس 2+Fe
۲- حالت فریک 3+Fe
۳- حالت فریل 4+Fe که با تعدادی آنزیم ( مثلا" پیروکسیدازها ) پایدار شده است.
۴- آهن ( VI) هم معروف است ( اگر چه کمیاب می باشد ) . در صورتی که به شکل فرات پتاسیم باشد، (K2FeO ) یک اکسیدکننده ی انتخابی برای الکل های نوع اول میباشد. این ماده جامد فقط در شرایط خلاء و ارغوانی تیره پایدار است، هم به صورت محلول سوز آور و هم به صورت یک ماده ی جامد.
۵- کاربید آهن Fe3C به نام سمنتیت معروف است.
بیولـــــــوژی:
آهن ، اتم اصلی مولکول ( هم بخشی از گلبول قرمز ) و بنابراین جزء ضروری تمامی همو پروتئینها محسوب میشود. به همین علت ، وجود این عنصر در حیوانات حیاتی میباشد. همچنین آهن غیر آلی در زنجیرههای آهن – گوگرد بسیاری از آنزیم هایا فت میشود. باکتری ها اغلب از آهن استفاده میکنند. وقتی بدن در حال مبارزه با یک عفونت باکتریایی است، برای عدم دستیابی باکتری به آهن ، این عنصر را پنهان می کند.
ایزوتوپ ها :
آهن به طور طبیعی دارای چهار ایزوتوپ پایدار Fe.54 , Fe.56 , Fe.57 , Fe.58 میباشد. فراوانی نسبی ایزوتوپ های آهن درطبیعت تقریباً Fe.54 - 8/5%، Fe.56 - 7/91%، Fe.57 - 2/2% و Fe.58-3/0% است. Fe-60 که نوکلید پرتوزای غیر فعا ل است، دارای نیمه عمر 5/1 (Myr) میباشد. بیشتر تلاش گذشته برای اندازه گیری ترکیبات ایزوتوپی آهن به علت فرآیندهایی که توام با نوکلئوسنتز( مانند :مطالعات شهاب سنگ ها ) و شکل گیری کانیها هستند، حول محور تعیین انواع مختلف Fe -60 صورت گرفته است.
دروهلههای مختلف ، شهاب سنگهای Semarkona و Chervony Kut می توان بین تمرکز Ni- nickel | 60 محصول اخترچه ( Fe-60 و فراوانی ایزوتوپ های پایدار آهن ارتباطی یافت که د لیلی برای وجود آهن-60 در زمان شکل گیری منظومه شمسی می باشد. احتمالا" انرژی آزاد شده توسط فروپاشی آهن-60 به همراه انرژی رها شده بر اثر فروپاشی نوکلئید پرتوزای Al-26، در ذوب مجدد و تفکیک اخترچههای بعد از شکلگیری آنها 4,6 میلیارد سال پیش تا ثیر داشته است. فراوانی Ni-60 موجود در مواد فرازمینی نیز ممکن است آگاهی بیشتری در مورد منشاء منظومه ی شمسی و تاریخ ابتدایی آن ارائه نماید. در بین ایزوتوپ های پایدار فقط آهن 57- دارای اسپین اتمی است (2/1-). به همین خاطر آهن 57 در شیمی و بیوشیمی به عنوان یک ایزوتوپ اسپینی دارای کاربرد است.
آهن فلزی نسبتاً فراوان در جهان است و اهمیت حیاتی در زندگی حیوانات و گیاهان دارد . فلزی خالص که دارای فعالیت شیمیایی زیاد است و مخصوصاً در هوای مرطوب به سرعت زنگ می زند .
آهن دارای خواص مغناطیسی مهمی است ، و یکی از ترکیبات مهم سازنده زمین می باشداین عنصر در خورشید و انواع ستاره ها یافت می شود وهسته پایداری دارد. آهن یکی از ترکیبات اصلی شهاب سنگها می باشد که در سیدریتها و عناصر فرعی وجود دارد. هسته زمین دارای ترکیبی از 10 درصد آهن و هیدروژن دارد، این فلز چهارمین عنصر فراوان از نظر وزنی در پوسته زمین است .عمومی ترین ترکیب این عنصر هماتیت است که در داخل رسوبات سیاه سواحل و صخره های رودخانه ها یافت می شود.
آهن معمولی ترکیبی از 4 ایزوتوپ می باشد، ده ایزوتوپ د یگر نیز از این عنصر شناخته شده است. آهن نقش مهمی در زندگی جانوران به علت وجود آن در همگولبین خون دارد. تاکونیت یکی از ترکیبات مهم آهن می باشد که از آن برای مصارف تجاری آهن استفاده می شود. آهن به صورت خالص استفاده تجاری چندانی ندارد ولی وقتی با کربن و دیگر فلزات ترکیب شود مصارف زیادی دارد. عنصر خالص آهن دارای خاصیت واکنش پذیری شیمیایی بالا است و به سرعت زنگ می زند و اکسید می شود، در هوای مرطوب و خیلی گرم این خاصیت افزایش پیدا می کند.
آهن دارای 4 آلوتروپی است که عبارتند از: آلفا، بتا، گاما، امگا. آلفا شکلی از آهنربا است که از بتا تغییر شکل پیدا کرده باشد. آهن خام یا چدن شامل 3 درصد کربن با میزان مختلفی از عناصر گوگرد، سیلیسیوم ، منگنزو فسفر می باشد.
آهن دارای خاصیت سخت، شکننده، نسبتاً زودگداز و آلیاژها و ترکیبات مختلف آن کاربردهایی مثل فولاد دارند. آهن ورزیده شامل یک دهم درصد کربن، بادوام، چکش خوار، ذوب شونده سریع و معمولاً ساختار الیافی دارد. فولاد کربنی ترکیبی از آهن و به میزان کم منگنز و گوگرد و فسفر و سیلیسیوم می باشد. آلیاژهای فولاد عبارتند: از فولاد کربنی یا ترکیبی از عناصر د یگر مثل نیکل و کروم و وانادیم و غیره. آهن ارزان ، فراوان بسیار مفید و فلز مهمی در صنعت می باشد.
تاثیرات زیست محیطی آهن:
آهن 3 آرسنیت و پنتاهیدرات ممکن است برای محیط زیست خطرناک باشند. به همین دلیل باید توجه خاصی به گیاهان، هوا و آب شود. به طور کلی باید از ورود مواد شیمیایی به محیط زیست جلوگیری به عمل آورد، زیرا اکثر مواد شیمیایی برای مدت زمان طولانی در طبیعت باق می ما نند و از خود مقاومت نشان می دهند.
خواص فیزیکی و شیمیایی عنصرآهن :
عدد اتمی: 26
جرم اتمی:55.845
نقطه ذوب: 1244C°
نقطه جوش : 1962C°
شعاع اتمی: Å 1.72
ظرفیت: 2,3
رنگ: فلزدرخشان مایل به خاکستری
حالت استاندارد: جامد
نام گروه:8
انرژی یونیزاسیون: 7.87Kj/mol
شعاع یونی : Å 0.645
الکترونگاتیویته: 1.83درجه پاولینگ
حالت اکسیداسیون:2,3,4,6
دانسیته: 7.873
گرمای فروپاشی: Kj/mol 13.8
گرمای تبخیر : Kj/mol 349.6
مقاومت الکتریکی : Ohm m 0.0000000971
گرمای ویژه: J/g Ko 0.44
دوره تناوبی:4
شماره سطح انرژی : 4
اولین انرژی : 2
دومین انرژی : 8
سومین انرژی : 14
چهارمین انرژی : 2
اشکال دیگر :
اکسید آهن FeO ، مگنتیت Fe3O4 و هماتیت Fe2O3 ،دی کلرید آهن FeCl2 و تری کلرید آهن FeCl3.
.کاربرد :
در تهیه فولاد و آلیاژکاری کاربرد دارد و از انواع آلیاژهای آن لوازم و ابزار بسیار متنوعی تولید می شود . سازنده اصلی خون جانوران و همراه اکسیژن در رگهای خون حمل می شود .
روش شناسایی :
1-Coupled Plasma Spectrography ICP:Inductively
2-XRF:X-Ray Fluorescence Spectrometr
3-NA:Neutron Activation Analysis
4-Acti ENAA:Etra-Thermo Neutro vation Method
| ||||||
|
عمومی | ||||||
|
نام, علامت اختصاری, شماره |
Iron, Fe, 26 | |||||
|
گروه شیمیایی |
فلز انتقالی | |||||
|
گروه, تناوب, بلوک |
(8« VIIIB ),4,d | |||||
|
جرم حجمی, سختی |
7874kg/m3, 4.0 | |||||
|
رنگ |
فلزی درخشان با | |||||
|
خواص اتمی | ||||||
|
وزن اتمی |
55.845amu | |||||
|
شعاع اتمی (calc.) |
140pm | |||||
|
شعاع کووالانسی |
125pm | |||||
|
شعاع واندروالس |
___ | |||||
|
ساختار الکترونی |
[Ar3d64s2 ] | |||||
|
-e به ازای هر سطح انرژی |
2, 8, 14, 2 | |||||
|
درجه اکسیداسیون (اکسید) |
2,3,4,6 (آمفوتریک) | |||||
|
ساختار کریستالی |
بدنه مکعب مرکزی | |||||
|
خواص فیزیکی | ||||||
|
حالت ماده |
جامد (فرومغناطیس) | |||||
|
نقطه ذوب |
1808K(2795°F) | |||||
|
نقطه جوش |
(3023K(4982°F | |||||
|
حجم مولی |
7.09 ש«10-6»»مترمکعب برمول | |||||
|
گرمای تبخیر |
349.6kJ/mol | |||||
|
گرمای هم جوشی |
13.8kJ/mol | |||||
|
فشار بخار |
7.05Pa at 1808 K | |||||
|
سرعت صوت |
4910 m/s at 293.15 K | |||||
|
متفرقه | ||||||
|
ظرفیت گرمایی ویژه |
440J/«kg*K) | |||||
|
رسانائی الکتریکی |
9.93 106/m اهم | |||||
|
رسانائی گرمایی |
80.2 W/m*K | |||||
|
1st پتانسیل یونیزاسیون |
762.5kJ/mol | |||||
|
2nd پتانسیل یونیزاسیون |
1561.9kJ/mol | |||||
|
3rd پتانسیل یونیزاسیون |
2957kJ/mol | |||||
|
4th پتانسیل یونیزاسیون |
5290kJ/mol | |||||
|
پایدارترین ایزوتوپها | ||||||
فلز آهن
آهن
تاریخچه آهن
بشر از دیرباز با آهن و فولاد و چدن که امروزه به عنوان پرمصرف ترین فلزات جهان می باشند آشنا بوده است . استفاده از آلیا?های آهن در بناها ، حتی به میزان اندک و محدود در بناهای قرون گذشته کمتر به چشم می خورد . اما تنها از اوایل قرن هجدهم با پیشرفت صنعت استفاده از این فلز رو به فزونی گذاشته است . در ابتدا از آهن برای کارهای کوچک ، همچون تزئینات و یا کلاف بندی بناهای سنگی استفاده می شد ، اما به علت عدم توسعه صنایع تصفیه آهن استفاده از این فلز محدود بود تا اینکه در اواسط قرن هجدهم در انگلستان قدمهای شایان توجهی در بهبود و پیشرفت صنعت آهن برداشته شد و اولین .بناهایی که از آهن در ساخت ساز آنها استفاده شد ، در اواخر قرن هجدهم ساخته شدند و این آغاز فصل نوینی در صنعت ساختمان سازی بود
نحوه تولید آهن و استفاده از آن در ساختمان
تولید آهن در واقع تشکیل شده است از یک سری عملیات وابسته به هم تا رسیدن به تولید نهایی که در این روند آهن خام تولید و سپس تبدیل به فولاد مذاب و این فولاد ریخته گری شد ، و به ورق و تسمه و یا پروفیل تبدیل ، یا اینکه توسط نورد سرد رولهای ورق فولادی را به تسمه و پروفیل تبدیل می کنند . همچنین از سرباره (موادی که به عنوان ناخالصی روی آهن در کوره قرار میگیرند ) . کوره ذوب آهن به .عنوان موادی با ارزش برای تولید مصالح ساختمانی استفاده می شود که از آن جمله می توان در تهیه سیمان مصالح عایق حرارتی مانند پشم سنگ را نام برد
نقش کربن در آهن و انواع آن
کربن موجود در آهن تاثیر بخصوصی در ساختار مولکولی آهن گذاشته بنحوی که تغییر مقدار آن باعث می شود که اشکال مختلفی از آن بوجود آید و خواص فیزیکی متفاوتی داشته باشد . برای شناخت بیشتر .به بررسی انواع آن می پردازیم
آهن نرم : این نوع آهن که در آن 2/0% کربن وجود دارد در قدیم برای وسایل و قسمتهایی که باید کشش زیادی را تحمل می کردند به کار میرفت . این نوع آهنها انعطاف پذیر بوده و به همین خاطر در .کارهای تزئینی از آن استفاده می شود و به علت دمای ذوب بالا جوشکاری یا ریخته گری با آن امکان پذیر نیست
آهن معمولی : این آهن حدود 2% کربن در خود دارد و بر خلاف آهن نرم نمی توان روی آن در حالت مذاب کار کرد و عموما یک ماده شکننده است ، اما مقاومت آن در برابر خوردگی را به خوبی در استفاده .آن در ساخت دیگهای بخار ، هدایت آب باران ناودانها و دیگر وسایل می توان مشاهده نمود
شناخت چدنها
چدنها که در واقع همان آهن با درصدهای مختلف کربن می باشند را می توان به انواع مختلفی تهیه کرد مانند چدن خاکستری که دارای مقادیر بیشتری کربن نسبت به انواع دیگر آن است که همین باعث خصوصیت شکنندگی آن می شود ، رنگ آن خاکستری بوده و در جاهایی که باید بار زیادی را تحمل کرد از آن استفاده می شود . چدن سفید که از سرد کردن سریع مذاب آهن حاصل می شود را می توان .نرم کرد تا مقدار شکنندگی آن کاهش یابد و انعطاف پذیر گردد . این چدن به چدن چکش خوار نیز معروف است
ساختار فولاد و تاثیر ناخالصی در آن
فولاد ازچدن سفید تهیه می کنند و درصد کربن در ان
بین 70 تا 71 درصد می باشد که با توجه به همین بالا و پایین بودن درصد
کربن مصارف مختلفی از آن می توان کرد و ضمن آنکه باید گفت وجود کربن بیش از
حد فولاد را شکننده می کند و بر سختی آن
می افزاید و همچنین عامل پایین
آمدن درجه ذوب فولاد است . وجود منگنز و سیلیسیوم مقاومت و سختی فولاد را
افزایش می دهد و مانع از چکش خواری و شکل پذیری آن می شوند . بودن فسفر ،
فولاد را شکننده می کند و همینطور گوگرد عامل پایین آمدن مقاومت آن در
برابر ضربه می باشد . وجود کرم ، کشش فولاد را افزایش داده و مانع از زنگ
زدن آن می شود . مس در فولاد باعث
.می شود که زنگ نزده و دیر بپوسد
نحوه تولید قطعات از فولاد
یکی از راههای تولید قطعات ، ریخته گری می باشد که در آن فولاد یا آهن مذاب را در قالب مخصوص می ریزند و پس از سرد شدن قطعه مورد نظر بدست می آید که بعد از عملیات بر روی آن آماده مصرف می گردد . نورد یکی دیگر از روش های تولید قطعات است که از شکل دادن به شمش فلزی که از میان غلتک های دوار به صورت مرحله ای عبور می کند بدست می آید . این روش ممکن است به صورت نورد سرد و یا گرم انجام پذیرد. چکش کاری نیز روشی است که در آن قطعه فلزی به کمک ضربات مستمر چکس یا پرس به شکل مورد نظر تبدیل می شود و برای ساختن پرچ و میخ از روش .چکش کاری استفاده می شود . در واقع اکثر قطعات فولادی مورد مصرف در ساختمانها با استفاده از همین روشها شکل می گیرند
اشکال مختلف فولاد
از فولاد در صنعت ساختمان به شکلهای مختلفی استفاده می کنند که از آن جمله می توان به ورق ، تسمه ، اتصالات ، لوله ، پروفیل ، تیرهای فولادی و یا کابل فولادی اشاره کرد . که در مودر کابلهای فولادی باید گفت از مصارف عمده و خاص فولاد می باشد که نحوه تولید آن به این ترتیب است که میله های باریک فولاد نرم شده را از روی دیسکهای روغن کاری شده توسط کربید تنگستن عبور داده و طول آن را تا 10 برابر افزایش می دهند و در عین حال باعث می شود کشش و مقاومت فولاد افزایش و انعطاف پذیری آن کاهش یابد . برای تولید کابلهای فولادی مخصوص سازه های معلق یا بتن فشره یک دسته از کابلها جدا از هم را به هم پیچانده تا یک کلاف درست شود آنگاه یک دسته کلاف را دور یک دسته آهنی می بافند تا یک طناب درست کنند و سپس یک دسته طناب را به هم می بافند تا کابل مناسب .ایجاد کنند
استفاده از فولاد در کارهای اجرایی ساختمان
به طور کلی استفاده از فلزات در ساختمان از اهمیت فراوانی برخوردار است چنانچه از آن در سازه ساختمان ، پوشش ها و تزئینات و یراق آلات استفاده می شود . در مودر کاربرد فولاد در ساختمان در بحث کارهای سنگین می توان به اشکال ورق و لوازم و اتصال مانند پیچ و مهره و پرچ هایی که در کارهای فلزی و اسکلت سازی مصرف می شوند اشاره کرد . همچنین در اینجا باید گفت که قطعات فولادی باید از زنگ زدگی و نواقصی که به مقاومت و یا شکل ظاهری آنها لطمه می زند عاری باشند تیرها و ستونها باید حتی الامکان یکپارچه باشند و از وصله کردن قطعات کوتاه خودداری شود . به کار بردن آهن مصرف شده به طور کلی ممنوع بوده و مگر آنکه در محاسبات به آن توجه شده باشد . اسکلت فلزی را باید توسط ضد زنگ ، رنگ نمود تا مورد محافظت قرار گیرد . ضمن آنکه باید گفت این رنگ زدن در فاصله 5 سانتی متر محل جوش دادن متوقف می شود و پس از جوشکاری رنگ کردن تکمیل می شود . به قطعات فولادی داخل بتن نباید رنگ یا روغن زده شود . باید از مجاورت موادی .مانند گچ و آهک که باعث پوسیدگی فولاد می شود جلوگیری کرد
در استفاده از فولاد در کارهای سبک فلزی مانند در و پنجره ، قابها ، ورقهای محافظ و تزئیناتی باید به این نکات اشاره کرد که در هنگام ساخت و نصب رعایت قائم بودن و افقی بودن قطعات همچنین بدون تاب بودن صفحات حائز اهمیت می باشد . جوشکاری در روی کار قطعات فلزی باید مخفی و یا صاف شده باشد . ساخت چارچوبها و لنگرهای در و پنجره باید به نحوی باشد که به خوبی هوا بندی شده و .آب چکان ها به راحتی آب را از سطح پنجره و نقاط قابل نفوذ دور نمایند